ننشر لكم قانون بويل,حل تجربة قانون بويل,تطبيقات قانون بويل في الطب,قانون بويل وشارل,تقرير عن تجربة قانون بويل,تجربة تحقيق قانون بويل عمليا pdf,نظرية تجربة قانون بويل,ماهي استخدامات قانون بويل,تطبيقات على قانون بويل في الحياة العملية علي موقع كلام نيوز. www.klamnews.com
تعريف قانون بويل.

ننشر لكم قانون بويل,حل تجربة قانون بويل,تطبيقات قانون بويل في الطب,قانون بويل وشارل,تقرير عن تجربة قانون بويل,تجربة تحقيق قانون بويل عمليا pdf,نظرية تجربة قانون بويل,ماهي استخدامات قانون بويل,تطبيقات على قانون بويل في الحياة العملية علي موقع كلام نيوز. www.klamnews.com
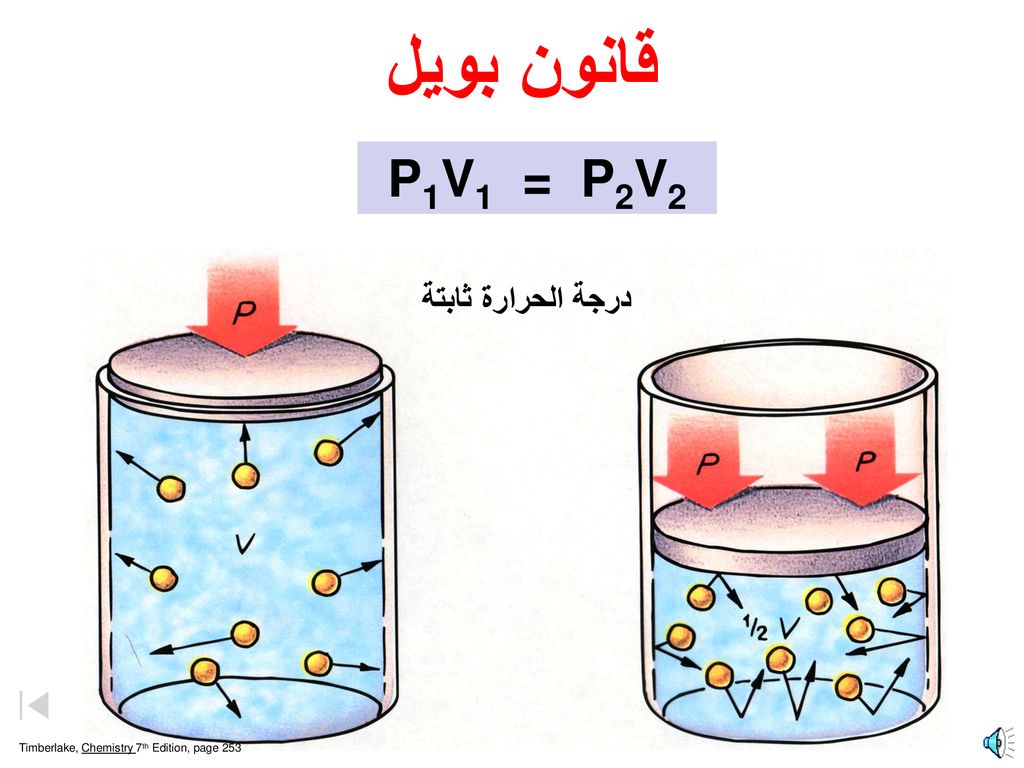
هو إحدى قوانين الغازات والتي على أساسها تم اشتقاق قانون الغازات المثالية وهو ينص على أن حجم كمية محددة من الغاز يتناسب عكسياً مع الضغط الواقع عليه عند ثبوت درجة حرارته.
وبصيغة رياضيّة يُمكن التعبير عن القانون كما يأتي : ح ض = ث
حيث: ض: ضغط الغاز، ويقاس بعدّة وحدات أهمّها (مم زئبق، أو بار، أو باسكال).
ح: حجم الغاز، ويُقاس بعدّة وحدات منها (اللتر، أو السنتيمتر مكعّب، أو ديسيلتر وغيرها).
ث: ثابت.
اشتقاق قانون بويل:
يتناسب حجم الغاز المحصور عكسيّاً مع الضغط الواقع عليه.
ض α 1 / ح
وبتحويل التناسب إلى علاقة مساواة ينتج الشكل الآتي:
ض = ثابت × ( 1 / ح )
وبترتيب العلاقة السابقة:
ض × ح = ثابت
وعندما يكون لدينا ظرفان مختلفان للغاز عند ثبوت درجة الحرارة فإن :
ض1 × ح1 = ثابت ض2 × ح2 = ثابت وبمساواة الطرفين فإنّ : ض1 × ح1 = ض2 × ح2 وعند تطبيق قانون بويل يجب أن تتجانس وحدات الحجم والضغط علماً أنّ ( 1 ضغط جوي = 760 مم زئبق ) و ( 1 لتر = 1000 سم3 ).
مثال توضيحي: تشغل كتلة من غاز الأوكسجين حجماً مقداره 40 سم3 عند 1000 ضغط جوي، احسب حجمه عند ضغط 0.8 ضغط جوّي، مع العلم أنّ درجة حرارته ثابتة. الحل : ض1 × ح1 = ض2 × ح2 1 × 40 = 0.8 × ح2 40 / 0.8 = ح2 ح2 = 50 سم3.
ننشر لكم قانون بويل,حل تجربة قانون بويل,تطبيقات قانون بويل في الطب,قانون بويل وشارل,تقرير عن تجربة قانون بويل,تجربة تحقيق قانون بويل عمليا pdf,نظرية تجربة قانون بويل,ماهي استخدامات قانون بويل,تطبيقات على قانون بويل في الحياة العملية علي موقع كلام نيوز. www.klamnews.com